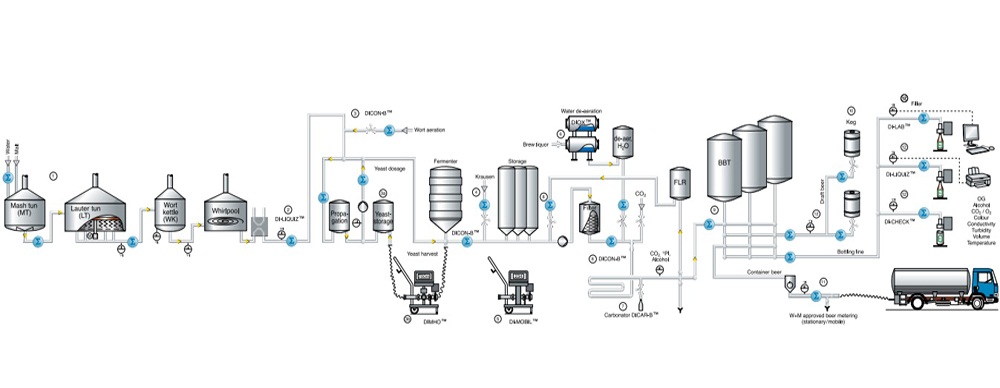
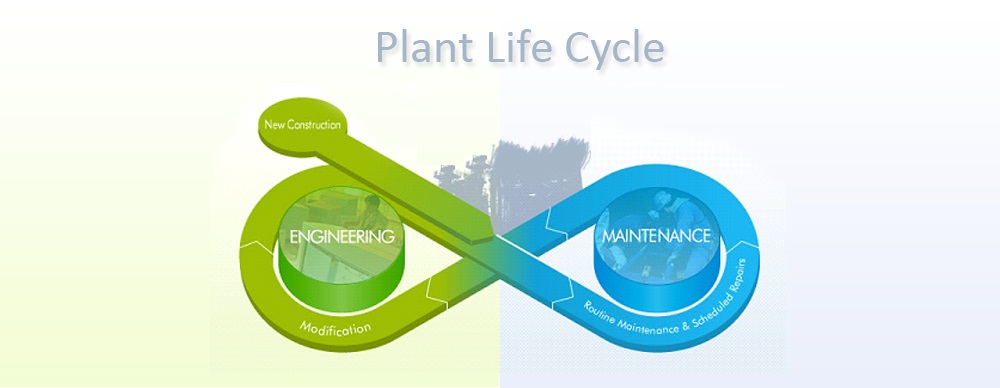
Validatie en verificatie (V & V)
Biofluid biedt GMP diensten als onderdeel van de kwalificatie en validatie van planten, computer systemen en processen in de farmaceutische industrie, consulting voor de invoering van GMP processen in engineering & productie, Qualification & Validation
- Het uitvoeren van eenvoudige en gedetailleerde Risicobeoordeling
- Vendor Qualification & Procurement bijstand
- Voorbereiding van Validation masterplan
- Voorbereiding van de DQ-rapporten, IQ en OQ protocollen en rapporten
- Prestatie kwalificatie
- Procesvalidatie
- Schoonmaken validatie
- Planning, coördinatie en uitvoering van alle kwalificatie / validatie activiteiten
- Computer systeem validatie
Procesvalidatie:
Om optimaal gebruik van personeel en technische middelen te maken, is het verstandig om te plannen vroeg voor validatie projecten. Het is noodzakelijk om optimaal coördineert de ontwikkeling, processen, product karakterisering, productie en kwaliteitszorg om de best mogelijke totale project prestatie waarop geen ruimte laat en voorkomt ontslagen bereiken.
Wij ondersteunen u bij de implementatie van Quality by Design (QbD) met de belangrijkste instrumenten die hiervoor nodig zijn: Design of Experiments (DoE) en het uitvoeren van risicoanalyses. Passende definitie en classificatie van uw besturingssysteem en acceptatie varieert evenals de bijbehorende alert en actielimieten garanderen een optimale procesbeheersing.
- Wij bieden ondersteuning voor het ontwerp en de coördinatie van uw validatie project
- Wij bieden advies en coördinatie, alsmede het creëren van risicoanalyses / assessments en validatie documentatie (brondocumenten) voor consistentie studies.
- Wij bieden stabiliteit studies voor media-, proces buffers en proces tussenproducten
Wij bieden ondersteuning op voorhand van uw proces validatie project, zodat de eisen voor een soepele validatieproces zijn verzekerd:
- planning van GMP-compatibele fabrieken
- planten kwalificatie en computer validatie
- proces karakterisering
- validatie van analysemethoden
- opstellen van SOP's
- training van uw medewerkers
Computer Validatie:
Wij coördineren de validatie van uw systemen over de gehele levenscyclus.
Geautomatiseerde systemen die de kwaliteit van het product en de veiligheid van het product van geneesmiddelen beïnvloeden, moeten voldoen aan de eisen van de GMP-regels en moet worden gevalideerd.
Biofluid plannen en coördineert de validatie van geautomatiseerde systemen in overeenstemming met de EU en de VS-regels en / of in overeenstemming met de eisen van de nationale autoriteiten.
We geschikte validatie maatregelen te definiëren voor uw systeem die zijn aangepast voor het risico voor de kwaliteit en veiligheid van uw producten, en we over de gehele levenscyclus coördineren de validatie van uw systemen.
Wij ondersteunen u bij het:
- definitie van het GMP kritische factor van uw systemen (uitvoering van systeem risicoanalyses)
- opstellen van validatie masterplannen volgens GAMP5
- ontwikkeling van de kwaliteit en projectplannen
- uitvoering van functionele risicoanalyses volgens FMEA, op risico gebaseerde omschrijving van de omvang van de test
- uitvoering van 21CFR Part 11 evaluaties
- coördinatie van de testfase van het project
- coördinatie van het change management bij het project
- evaluatie en revalidatie van reeds bestaande systemen
- voorbereiding van de noodzakelijke SOP
- training van uw medewerkers
- Maak gebruik van de advisering aan de gevalideerde status van uw geautomatiseerde systemen tijdens operaties te handhaven (change management, configuration management)